临床试验数据库登记信息显示,一种靶向慢性乙肝患者(CHB)治疗性疫苗T101的II期临床试验初步结果,将于今年12月份完成。登记于临床试验数据库中,该药为乙肝在研新药,II期为联合核苷酸类似物治疗CHB的安全性和有效性试验。
乙肝在研新药T101,一种靶向治疗性疫苗,II期初果预计12月完成
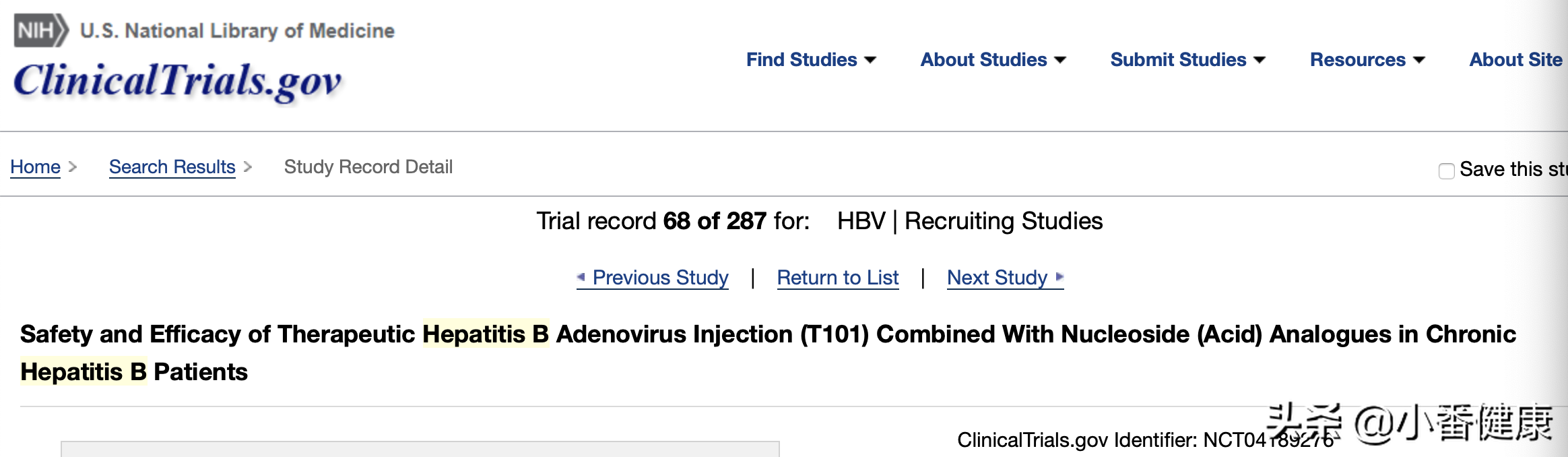
由天士力创世杰(天津)生物制药有限公司主办,首次发布日期:2019年12月6日,最新发布日期:2019年12月17日,初步完成日期:2020年12月,全部完成日期:2021年12月。乙肝在研新药T101的II期临床试验题目:T101联合核苷酸类似物治疗慢性乙型肝炎的安全性和有效性,一项多中心、随机、开放标签、分组对照研究。II期预计招募100名受试者,T101是靶向治疗CHB的治疗性乙肝疫苗,联合核苷酸类似物有恩替卡韦(ETV)和富马酸替诺福韦二吡呋酯(TDF)。
主动比较组1:T101+ETV/TDF,研究人员将观察第1天(第0周)、第8天(第1周)、第15天(第2周)、第106天(第15周)、第113天(第16周)、第120天(第17周)、第211天(第30周)、第218天(第31周)、第225天(第32周)、第316天(第45周)、第323天(第46周)、第330天(第47周)注射T101;每天连续给药一次ETV或TDF,直至第420天;
主动比较组2:T101+ETV/TDF,研究人员将观察第1天(第0周)、第106天(第15周)、第211天(第30周)、第316天(第45周),采用注射给药一次T101;每日连续注射1次ETV/TDF,直至第420天。主动比较组3:ETV或TDF,受试者每日连续口服1次ETV或TDF,直到第420天;主动比较组4:聚乙二醇干扰素α-2b+ETV/TDF,即ETV/TDF+Peg-IFNα-2b,受试者每周连续给药1次Peg-IFNα-2b,至第330天(第47周);ETV或TDF每日连续给药1次,直至第420天。
根据登记于临床试验数据库信息看,乙肝在研新药T101是一种靶向慢性乙肝患者的治疗性乙肝疫苗,II期人体临床试验初步完成时间是今年12月,II期纳入标准是18-60岁的成人慢性乙肝(CHB),同时应满足如下要求方能进入到T101的II期临床研究中,包括男性体重不低于50公斤,女性体重不低于45公斤,符合2015指南诊断和治疗乙肝标准;目前服用NAs1年以上;HBV-DNA小于100iu/ml;乙肝表面1:1000,促甲状腺激素受体抗体2×ULN;过敏体质或对实验药物、辅料过敏;计划接受或已经接受器官移植;在试验前3个月内参与任何临床试验或服用任何IMP(试验药物);其他不能纳入调查人员判断的案件。需注意,以上均为乙肝在研新药T101的II期临床排除对象。
主要结果指标:平均60周给药随访期间,观察有有报告的不良事件;记录下不良事件,并确定其与乙肝在研新药T101之间的相关性;在给药后的第106天(15周)、211天(30周)、316天(45周)、337天(48周)、421天(60周),研究人员将根据上述不同时间点,记录下乙肝表面抗原变化;研究人员还将从基线时的表面抗原变化,评价T101的治疗效果。
次要结果指标:给药后的第106天(15周)、211天(30周)、316天(45周)、337天(48周)、421天(60周),研究人员将记录受试者的乙肝表面抗原下降百分比大于或等于1log的时间点;评价T101抗病毒作用;在给药后第106天(第15周)、第211天(第30周)、第316天(第45周)、第337天(第48周)、第421天(第60周),研究人员记录受试者乙肝表面抗原下降百分比大于或等于0.5log的时间点。

小番健康结语:以上介绍的T101的II期临床试验是一项全球性的多中心、随机、开放标签、分组对照研究,登记于全球临床试验数据库中(见上图)。II期临床试验主要评估T101联合核苷酸类似物治疗慢性乙肝的安全性和有效性,如上所提,联合恩替卡韦或替诺福韦以及干扰素,该药为在研的一种治疗性乙肝疫苗,II期临床初步完成将在2020年12月,具体试验方法和内容已在上方公布。


![郴州试管婴儿费用大约多少[试管婴儿费用] 郴州试管婴儿费用大约多少[试管婴儿费用]](/imgs/baidou-v2/upload/default/A36727B42.jpg)